Počet pacientů zařazovaných v Česku do klinických studií klesá – a spolu s ním i objem financí, které u nás farmaceutické firmy investují. Zlepšit situaci by mohl krok, který přichystalo ministerstvo zdravotnictví a jenž by měl vést ke zkrácení lhůt před uzavřením smlouvy mezi zdravotnickým zařízením a zadavatelem studie. Zároveň bychom však měli přistoupit i k dalším opatřením vedoucím k větší konkurenceschopnosti České republiky. Patří mezi ně centra excelence s navázanou sítí spolupracujících zařízení a urychlení náboru pacientů do studií. Důležitost klinických zkoušek z hlediska rychlého přístupu pacientů k inovativním lékům i úspor pro zdravotní pojištění připomněl včera třetí ročník dne klinických hodnocení.
„Klinické studie potřebujeme pro pacienty, kteří díky nim zejména v některých specializacích získají léčiva mnohem dříve. I naši lékaři se tak dostanou s inovativními léčivy do kontaktu dřív, než jsou v klinické praxi. Pokud jde navíc o výzkum zadávaný farmaceutickým průmyslem, je to pro zdravotnická zařízení významná část finanční,“ shrnuje přínosy klinických hodnocení Regina Demlová, vedoucí oddělení klinických hodnocení Masarykova onkologického ústavu. Během studií se navíc léčivo vyzkouší na zdejších pacientech, takže není nutné spoléhat se na data z daleké ciziny.
Bohužel však současný trend v tomto směru nabírá sestupnou tendenci. I když počty studií zůstávají vesměs stejné, klesá počet pacientů, kteří se do nich zapojují. Podle průzkumu mezi 22 společnostmi sdruženými v Asociaci inovativního farmaceutického průmyslu (AIFP) probíhalo v roce 2015 383 studií, zatímco loni jich bylo 429. Vedle toho se ale počet zapojených pacientů snížil z 26 278 na 21 530.
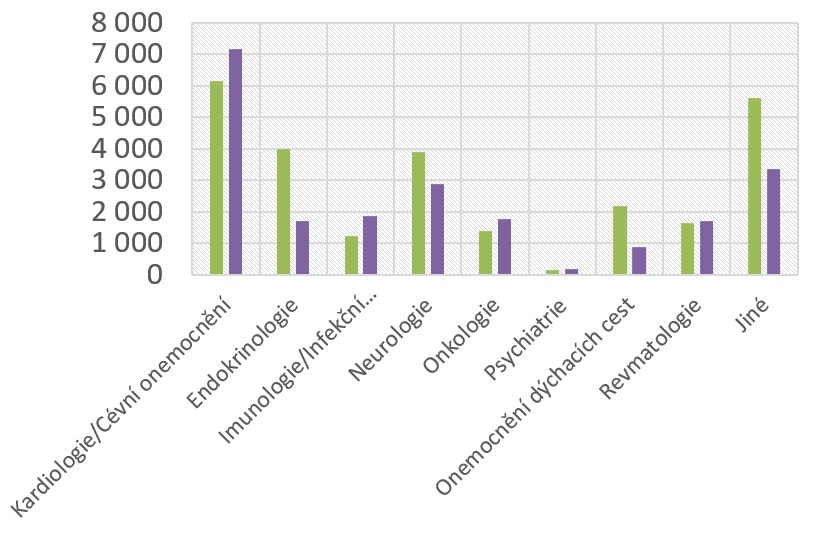
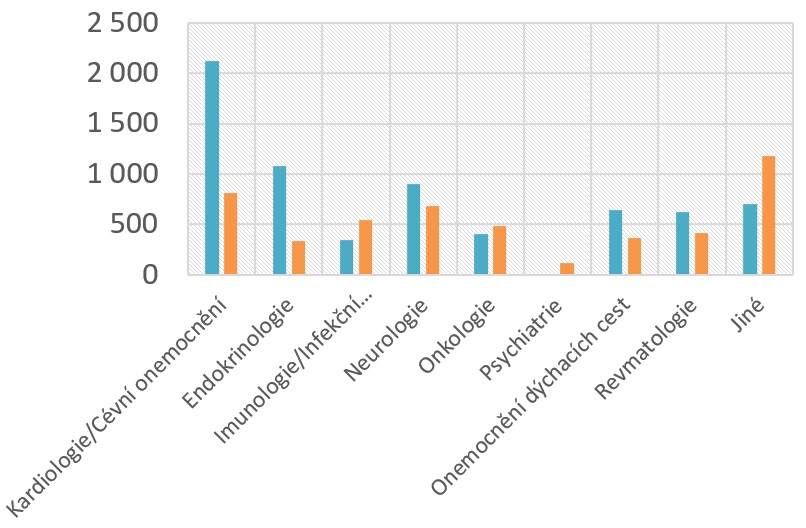
„Přípravky, které se k nám dnes dostávají, jsou velmi personalizované, určené pro úzké skupiny pacientů. Na to, abychom systém udrželi minimálně ve stejném rozsahu jako v minulých letech, by mělo množství studií řádově stoupat. Ve významných evropských nemocnicích se množství pacientů léčených v klinických hodnoceních pohybuje kolem 15 až 20 procent, zatímco na nejšpičkovějších pracovištích v Česku je to do deseti procent,“ nastiňuje výkonný ředitel AIFP Jakub Dvořáček s tím, že léky na vzácná onemocnění tvoří 30 procent nových léčiv. „Pozitivní je, že v oblastech, kde se vyskytuje větší množství vzácných onemocnění, a tam, kde je více pacientů, pro které znamená účast v klinickém hodnocení obvykle jedinou možností léčby, máme rostoucí trend. Je to zejména oblast onkologie, revmatologie a stoupá i počet klinických hodnocení v oblasti kardiologie,“ vypočítává Beata Čečetková, předsedkyně Platformy pro klinická hodnocení AIFP.
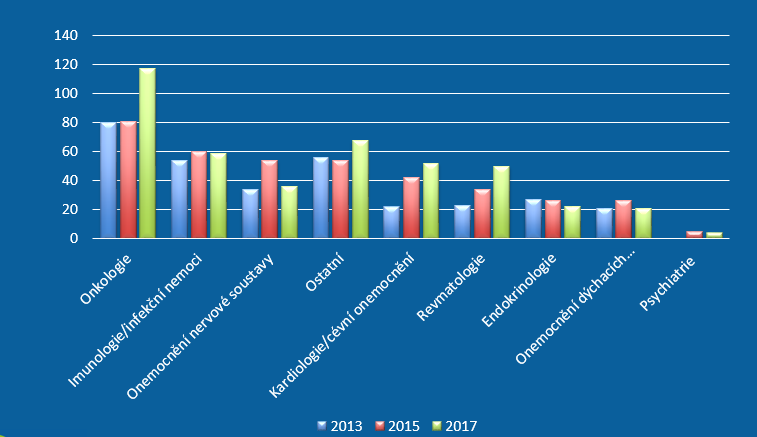
Vedle poklesu počtu zapojených pacientů se ale navíc snižuje i množství nově zahájených klinických hodnocení, a to z 81 v roce 2015 na 67 v minulém roce (počet nově zapojených pacientů klesl z 6812 na 4925). Ubylo také studií ve II. fázi, zatímco zkoušek ve III. fázi přibylo. „Stále pokulháváme v raných fázích klinického hodnocení, tedy těch, které jsou velice inovativní a mají možnost nejdříve přinést pacientům nové inovativní léčivo, zejména pokud jde o jedinou možnost léčby,“ přibližuje Čečetková. Proto by bylo na místě právě tyto fáze podpořit, a to rozvojem českých center excelence, lidských zdrojů a také vybavení.
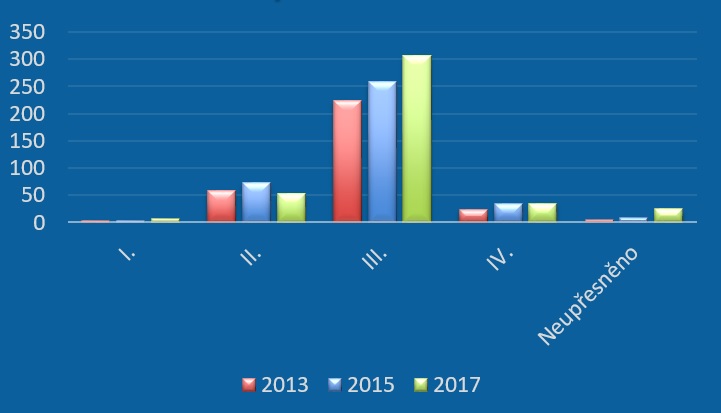
Výsledkem výše zmíněného je celkový pokles investic farmaceutických společností v Česku. V roce 2015 činily náklady 1,75 miliardy, loni to ale bylo už je 1,6 miliardy. Každá společnost pak loni průměrně vynaložila 75 milionů korun oproti 100 milionům v roce 2015. Podle dat SÚKL za uplynulý rok přitom tvořily inovativní farmaceutické společnosti sdružené v AIFP téměř polovinu všech zadavatelů klinických studií (podaly 127 žádostí), následovaly je malé, často biotechnologické firmy (104 žádosti), které ovšem taktéž často spolupracují s velkými farmafirmami. Menšinu zadavatelů pak tvořil ostatní farmaceutický průmysl (20 žádostí) a akademický sektor (18 žádostí).
Podobně jako my zaznamenává klesající trend Slovensko, oproti tomu Polsko a Rakousko posilují. „Podmínky tam nastavené umožňují výrobcům zahájit studie mnohem dříve. Ne že by se podceňovala etická rovina a méně se zkoumalo, zda je studie přínosné či nikoliv, ale vzhledem k rychlé identifikaci pacienta a schopnosti nabídnout mu možnost účasti ve studii jsou výrazně rychlejší než Česká republika,“ poukazuje Dvořáček.
Mohlo by vás zajímat
Když se chce, tak to jde. Důkazem je MOÚ
Situace ale není beznadějná. Jak zdůrazňuje Regina Demlová, je v Česku co nabídnout. „Máme zkušené týmy, dobře rozvinutý vztah mezi lékaři a pacienty – naši pacienti jsou o klinických studiích velmi dobře informovaní, a podpora klinických studií je i z řad zdravotnických zařízení,“ podtrhuje české přednosti docentka Demlová.
Důkazem toho, že potenciál v Česku máme, je právě Masarykův onkologický ústav. Tam se totiž daří počty klinických studií držet, přičemž počet měsíčně léčených pacientů dokonce stoupl z 231 v roce 2015 na 301 v roce 2017. Ústavu tak vzrostly úspory příjmů ze zdravotního pojištění ze 70 milionů v roce 2015 na 200 milionů v roce minulém. „Je to i z toho důvodu, že onkologická léčba je stále dražší. Když tedy můžeme pacientům nabídnout léčbu v rámci klinické studie, nevykazujeme ji na pojišťovnu a tím pádem šetříme velkou část financí ze zdravotního pojištění,“ konstatuje docentka Demlová. Zatímco celkově tak v Česku v roce 2011 ušetřily klinické studie na nákladech za léčiva 170 milionů, o dva roky později to bylo 333 milionů a v loňském roce 376 milionů korun.
K tomu, abychom se zlepšili celorepublikově, se snaží přispět i ministerstvo zdravotnictví. To má však v této oblasti pouze legislativní pravomoc, navíc je dnes tato problematika řešena na úrovni celé EU. „Uvítali jsme evropské nařízení, které by mělo usnadnit proces vstupu nových studií bez toho, aby došlo k omezení v oblasti kvality nebo že by se zhoršovaly podmínky. Nyní čekáme, až bude celá EU připravená a budou hotové některé klíčové IT infrastruktury. Tento krok ovšem pomůže všem státům EU, nikoliv čistě České republice,“ říká náměstek MZ pro legislativu Radek Policar. Nařízení 536/2014 by mělo nabýt účinnosti v roce 2020 a mělo by zjednodušit administrativní proces spojený s realizací klinických studií.
Doba kontraktace by se mohla zkrátit na týdny
Pokud tedy chceme uspět, musíme se snažit i v dalších ohledech. „Česká republika musí přijít s něčím, co nám umožní konkurovat Polsku, Rakousku, Německu… Našimi konkurenty nejsou asijské státy, o nichž se v minulosti mluvilo jako o těch, kdo k sobě přetáhnou většinu klinických hodnocení. Jsou to naši partneři v rámci EU,“ zdůrazňuje Jakub Dvořáček.
Ministerstvo si proto našlo cestu, jak by mohlo klinické studie podpořit, a to zejména ve smyslu koordinace a metodicky. Zjistilo totiž, že velmi problematické je uzavírání smluv mezi zadavatelem studie a zdravotnickým zařízením, které doposud trvalo velmi dlouho (psali jsme zde).
„Udělat dobrou smlouvu mezi zadavatelem a poskytovatelem tak, aby byla ochráněna všechna práva obou stran i pacientů, je složitý proces. Ukázalo se přitom, že to často trvá i déle než rok. Uvažovali jsme, co by mohlo pomoci, a začali jsme pracovat na jednotném textu smlouvy, kde by se, pokud to hodně zjednoduším, jen vyměnily smluvní strany a co je testováno. Všechny podmínky by tak byly předem dány a nemusela by probíhat dlouhá kontraktace. To by mohlo urychlit proces natolik, že by trval řádově týdny, nikoliv rok či déle, jak se často děje,“ uvádí Radek Policar.
Za spolupráce s několika desítkami subjektů z obou stran tak ministerstvo připravilo mustr smlouvy, který nyní dokončuje. Tento týden má přitom proběhnout poslední diskuse zapojených stran, text by pak měl být odsouhlasen a zveřejněn. „Věříme, že by to mohlo výrazně napomoci přístupu nových studií do České republiky,“ dodává Policar.
Tím by ovšem ministerská aktivita na tomto poli neměla skončit. Připravuje se totiž vznik pracovní skupiny, které by se měly účastnit jednotlivé dotčené subjekty a jež by měla provádět analýzu, hledat problematická místa a jejich řešení.
Potřebujeme zlepšit provázanost terénu a center
Oblastí, kterým je na místě věnovat pozornost, je hned několik. Pro realizaci klinických hodnocení je klíčová spolupráce s pacientskými organizacemi a skupinami pacientů v regionu. Regina Demlová přitom poukazuje, že už byla zahájena spolupráce s nedávno ustavenou ministerskou pacientskou radou. Pomoci by dále mohla také existence veřejně dostupných dat a pacientských registrů, která zvyšuje šanci na zařazení potřebného počtu pacientů do studií.
Pro nábor pacientů je důležitá také informovanost ošetřujících lékařů a jejich spolupráce s lékaři ve studiích. AIFP má proto poradnu, která se sice primárně zaměřuje na pacienty zajímající se o to, jaké klinické studie běží, zároveň ale poskytuje i informativní dopis pro ošetřující lékaře v případě, že se zatím s touto problematikou nesetkali.
„Je třeba pacienta včas diagnostikovat a referovat do centra, které klinickou studii provádí. U nás propojení mezi základním stupněm a centrem, kde studie probíhá, ne vždycky funguje,“ konstatuje Jakub Dvořáček.
Aby se situace zlepšila, je také třeba budovat centra excelence a na ně navázanou síť spolupracujících zařízení. „Masarykův onkologický ústav funguje jako národní onkologický ústav a je centrem excelence i pro časné fáze. Nám počty pacientů neklesají, a je to o tom, že formulujeme spolupráci s regionálními centry a referování pacientů pro účast pacientů v klinické studii do center excelence. Tento model by měl být v Česku uplatňován – fakultní nemocnice by měly být centry excelence pro provádění klinických studií a vybudovat si síť referujících pracovišť, aby se pacient třeba z Dolního Benešova dostal do nejbližšího centra, kde studie běží,“ vysvětluje Demlová.
Senátor Jan Žaloudík, ředitel Masarykova onkologického ústavu, na tomto místě vzpomíná, že už na přelomu tisíciletí žádal na ministerstvu pro MOÚ zřízení oddělení klinických hodnocení, které by mělo na starosti management studií. „Naivně jsem předpokládal, že během dalšího měsíce se to nařídí ve všech fakultních nemocnicích a ústavech, potažmo že to postihne i kraje. To byl rok 2001. Pokud vím, je dnes takové oddělení zřízeno v Motole, u nás a v Hradci Králové. V nemocnicích samozřejmě klinické studie běží – spontánně, nekoordinovaně. Je to také o síti pracovišť, které pracují podle jednotných standardů a věc popularizují mezi pacienty a lékaři. To nám také chybí,“ dodává profesor Žaloudík.
Michaela Koubová