Pokud dojde v Evropské unii k výpadku v dodávce léku, většinou nejde o problém, zda je preparát dostupný, ale kde je dostupný. Některé země EU čelí výpadkům prakticky denně, zatímco jiné se s nimi setkávají jen výjimečně, upozorňují autoři studie o příčinách výpadků v dodávkách léčiv v EU, kterou Evropská komise zveřejnila v prosinci. Tyto příčiny se nachází po celé délce lékového řetězce, od výroby až po národní cenové a úhradové mechanismy a systémy veřejného zadávání. A často spíše než s výrobou souvisí s komerčním rozhodováním výrobců a lékovými politikami jednotlivých států.
Země Evropské unie čelí v posledních letech stále častěji problémům s výpadky v dodávkách léků. Ty se týkají především starších generických léků bez patentové ochrany, přičemž zhruba ve čtvrtině případů jde o jedinou možnost léčby. Dopátrat se skutečných příčin těchto výpadků není jednoduché, nicméně jedna věc je zřejmá. I v rámci EU, která vznikla na principu solidarity, čelí některé země přerušeným dodávkám výrazně častěji než jiné. To poukazuje na některé systémové problémy, které tolik nesouvisí s výrobou léku a zajištěním potřebných základních surovin nebo účinných látek jako spíše s komerčním rozhodováním výrobců, zda se jim lék vyplatí udržet na trhu v té které zemi.
To jsou hlavní závěry obsáhlé studie o příčinách výpadků v dodávkách léčiv v zemích napříč EU mezi lety 2004 a 2020, kterou Evropská komise zveřejnila v prosinci. Její zpracování zadala eurokomisařka pro zdraví Stella Kyriakidesová s ohledem na připravovanou zásadní revizi unijní lékové legislativy, kterou plánuje předložit v druhé polovině tohoto roku. V necelých dvaceti doporučeních pak autoři studie navrhují, jak popsané problémy řešit. Zamyslet by se přitom neměla jen Evropská komise či farmaceutický průmysl, ale také samotné státy a jejich lékové agentury.
Analýzu zpracovalo konsorcium respektovaných mezinárodních konzultačních společností Technopolis Group, Milieu Law & Policy Consulting a Ecorys. Vedle širokých konzultací s klíčovými hráči vycházeli autoři z již dostupných analýz a dat sebraných od lékových agentur 22 zemí EU, které byly ochotny se průzkumu účastnit. Jde o zdaleka největší objem informací shromážděných v rámci Evropy, které se pak ještě dále provázaly s údaji o prodejích léčiv z databáze MIDAS mezinárodní společnosti IQVIA.
Většinou jde o lokální výpadky
Téma výpadků v dodávkách léčivých přípravků je na unijní úrovni přítomno již několik let. Opakovaně se jimi v posledních letech zabývali ministři zdravotnictví členských zemí EU i Evropský parlament. Dochází k nim totiž stále častěji. Částečně to je sice způsobeno i tím, jak se postupně vyvíjí důslednější systém hlášení, nicméně skutečnost, že situace kolem výpadků se stále zhoršuje, je očividná (více k tématu lékové soběstačnosti EU například zde).
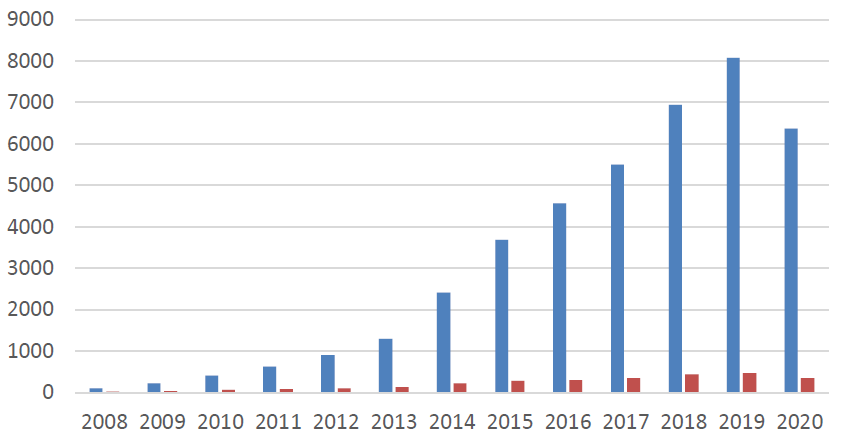
Nicméně většina těchto výpadků má lokální charakter, upozorňují autoři studie. Týkají se tedy pouze jedné či jen několika zemí (v průměru 4,5 státu). A to spíše než na nějaký globální problém na úrovni výroby ve třetích zemích poukazuje na rozdíly v distribuci léků uvnitř EU samotné. Jinými slovy, lék je v EU pacientům dostupný, ale jen v některých státech, přičemž některé země trpí výpadky prokazatelně častěji než jiné.
Dvě třetiny výpadků se vyřeší do tří měsíců
Analýza potvrdila již dříve zjištěnou skutečnost, že výpadky se týkají především starších generických léků bez patentové ochrany. Jde například o přípravky na zmírnění bolesti a vysoký krevní tlak, antiinfektiva nebo onkologické léky. Zhruba ve čtvrtině případů pak představuje nedostupný lék jedinou možnost léčby, tj. není možné provést jeho generickou záměnu s jiným přípravkem.
Příčiny těchto výpadků jsou různorodé a nachází se po celé délce lékového řetězce, od výroby surovin, přes distribuci až po národní úhradové mechanismy a systém veřejného zadávání. Zhruba z poloviny jde o problémy s výrobou a kvalitou. Asi za čtvrtinou případů stojí komerční rozhodnutí výrobce. A to včetně toho o stažení léku z trhu, kdy přípravek již nepřináší potřebný zisk a výrobci se s ohledem na související náklady nevyplatí jej udržovat na daném trhu. Další příčinou může být nečekaný nárůst poptávky jako například v případě vypuknutí pandemie nebo příliš rychlého nárůstu poptávky po nové terapii.
Mohlo by vás zajímat
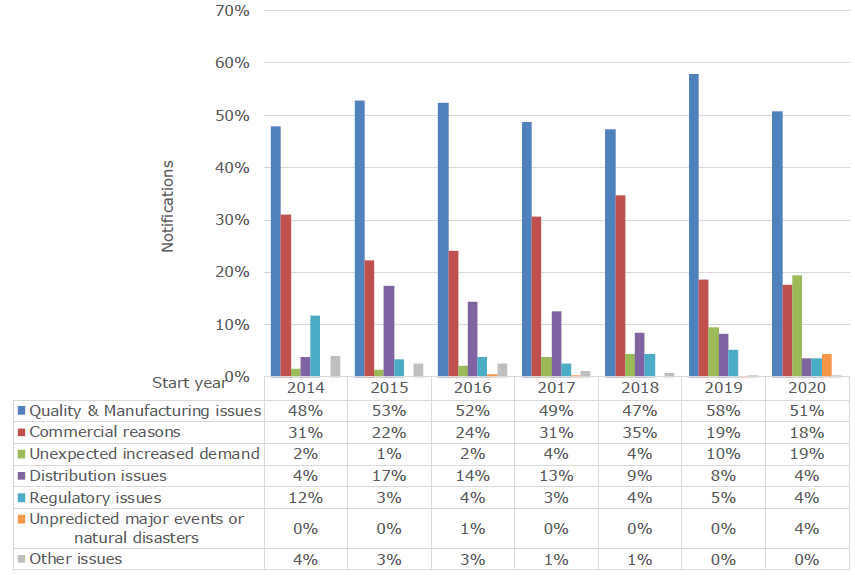
Délka výpadků se podle analýzy pohybuje v poměrně širokém rozmezí mezi několik dny až roky. Necelých 70 procent z nich se vyřeší v průměru do tří měsíců, průměrná délka výpadku je 137 dní. Nejrychleji se daří řešit výpadky spojené s rychlým nárůstem poptávky či jinou nečekanou událostí. Nejdelší jsou pak ty spojené s nutností vyhovět složitým administrativním požadavkům či vzniklé důsledku komerčních rozhodnutí výrobce.
Dopátrat se skutečných příčin není snadné
Autoři studie upozorňují, že dopátrat se skutečných příčin výpadků není vůbec snadné. Z 22 zemí EU, které se průzkumu zúčastnily, sbírá systematicky informace o příčinách jen patnáct z nich. A i tak jde často o hlášení velmi stručná a obecná. Uvádí se v nich například problém v místě výroby, ale již se neví, o co vlastně konkrétně jde.
Nelze ani s jistotou určit, do jaké míry se na výpadcích podílí faktory jako vyvedení části produkce mimo EU (například v případě zpracování surovin či výroby účinných látek ) nebo tzv. paralelní distribuce (nákup léku za nižší cenu v jedné zemi a jeho export do země jiné). Přitom právě o nich se ve veřejném prostoru hovoří v souvislosti s výpadky nejčastěji. Za zmínku stojí, že podle dostupných dat hlásí problémy se surovinami a výrobou účinných látek ve třetích zemích především výrobci generických léčiv.
Podle analýzy nelze přehlížet ani další rizikové faktory jako jsou národní cenové a úhradové politiky a lokální situace na trhu, kdy se výrobce rozhodne lék stáhnout prostě pro to, že už se mu ekonomicky nevyplatí jej tam držet. To se přitom v posledních letech děje stále častěji. Jde o situace, kdy se například objeví jiný lepší lék a poptávka po původním preparátu klesne. Nebo se podmínky na trhu změní natolik, že výrobce nemá z léku potřebný zisk.
Tak například data z Rumunska ukazují, že v 70 procentech případů, kde lék zmizel z trhu, tak výrobce učinil v důsledku komerčního rozhodnutí. Nevyplatilo se mu to. Z dostupných informací sice nelze zcela vyčíst, že by se případy stažení z trhu z komerčních důvodů týkaly častěji jen určité skupiny zemí, autoři studie nicméně výslovně zmiňují četnější výskyt kombinace České republiky spolu se Slovenskem a/nebo Slovinskem.
EU má co zlepšovat
Analýza a její výsledky má své limity, připouští její autoři. Neustále totiž naráželi na problém s nedostatkem standardizovaných a validních dat především na národní úrovni. Výrobci sice mají podle platné lékové legislativy z roku 2001 povinnost hlásit národním lékovým agenturám nejméně dva měsíce předem, pokud má jejich lék zmizet z trhu, jde nicméně o poměrně obecně formulovanou povinnost. A členské státy k jejímu vymáhání přistoupily v průběhu posledních dvaceti let odlišně. Některé se omezily například čistě na hlášení stavu zásob, jiné si přidaly další povinnosti nebo dokonce i sankce.
Až roku 2016 založila Evropská léková agentura (EMA) pracovní skupinu, která dostala za úkol koordinovat sledování dostupnosti léků v EU. V rámci ní pak postupně vznikla síť kontaktních míst jmenovaných každou unijní zemí, která mezi sebou, s Evropskou komisí a agenturou sdílí informace o hlášených výpadcích. Postupně také vznikly první pokyny a doporučení, jak výpadky sledovat a řešit.
Během covidové krize EMA dokonce vytvořila podobnou skupinu kontaktních míst uvnitř farmaceutického průmyslu. Ta má včas varovat před hrozícími problémy v dodávkách léků používaných v souvislosti s léčbou covidu-19 (jde například o anestetika, antibiotika, léky uvolňující svalové napětí nebo léky na tzv. off-label léčbu covidu).
To je však stále málo, myslí si autoři studie. Problém s výpadky totiž jen tak nezmizí a je třeba s tím něco dělat. Proto předkládají necelou dvacítku doporučení, nad nimiž by se Evropská komise, členské státy, distributoři i průmysl měli zamyslet. Některá jsou snadná a poměrně rychle realizovatelná, jiná jsou složitější a vyžadují systémové změny, které mohou být složité.
Jedna definice a seznam kritických léků
Tím prvním je sjednotit definici výpadku a standardizovat jeho hlášení. Země EU sice mohou využívat definici připravenou agenturou EMA , ta však například nerozlišuje fakt, do jaké míry se jedná o výpadek skutečně kritický (tj. má zásadní dopad na kvalitu a kontinuitu léčby) či jak dlouho trvá. To obecně omezuje sdílení hlášení a jejich využitelnost a analýzu. Jednoduché to není ani pro výrobce, kteří – pokud se výpadek týká více zemí – musí svá hlášení podávat v různé formě i obsahu. Databáze výpadků by nově mohla uvádět i informace o dostupných alternativách.
Dále by měl vzniknout unijní seznam kriticky důležitých léků, jejichž výpadek by ohrožoval kontinuitu a kvalitu léčby, a návrh postupu při řešení jejich nedostatku.
Autoři studie zdůrazňují, že všichni klíčoví hráči podél celého lékového řetězce i veřejná správa musí spolu komunikovat. Evropská komise s prohloubením postupně se rozvíjejícího dialogu na úrovni EU již počítá, nicméně analýza doporučuje vytvářet takové diskusní platformy i v jednotlivých zemích.
Zásahy do legislativy EU by si vyžádalo doporučení na zakotvení finančních sankcí v případě, že výrobci řádně nehlásí výpadky a neplní smluvené dodávky. Ti by si dále měli zpracovávat plány pro prevenci a řešení výpadků a udržovat bezpečnou zásobu surovin pro výrobu terapeuticky významných léků. V případě krize by se měla uvolnit jinak velmi přísná pravidla pro dovoz surovin či léků do EU. Zrychlit by se měla i procedura při vzájemném uznávání registrace léku získané v jednom státě v ostatních zemích EU.
Pozor na veřejné zakázky
O čem přemýšlet mají i samy národní vlády, upozorňují autoři studie. Podle nich totiž na rozhodování výrobců, zda lék ponechat na trhu nebo ho stáhnout, může mít vliv i systém veřejného zadávání.
„Pokud jsou nabídky (podané do veřejných zakázek) hodnoceny výhradně podle ceny bez zvážení další kritérií, jako je zajištění dodávek z více zdrojů, může to stlačit cenu léku natolik, že již není pro jiné potencionální účastníky řízení atraktivní na daném trhu zůstávat. To snižuje konkurenci a činí trh zranitelnějším, pokud u zbývajícího dodavatele dojde k výpadku,“ píše se v dokumentu. Stejný efekt mohou mít veřejné zakázky nastavené ve stylu „vítěz bere vše“, kdy se vítězný dodavatel stává dodavatelem jediným (podrobněji k tématu veřejných zakázek zde).
Nelze podceňovat ani dopad výše finančních sankcí v případě nesplnění dodávek, které zadavatelé uvádí v zadávací dokumentaci. Výrobci, zvláště u generických léků, tak mohou upřednostňovat účast spíše v těch řízeních, kde jsou sankce nižší nebo vůbec žádné.
„Za výpadkem léku často nestojí ani to, zda je lék dostupný, ale kde je dostupný,“ dočteme se ve studii. „To vyžaduje kritickou úvahu na straně všech účastníků řetězce nejen o roli těch druhých, ale také o odpovědnosti jich samotných,“ uzavírají její autoři.
Helena Sedláčková