Evropské nařízení o zdravotnických prostředcích (MDR) účinné od loňského května, potažmo nařízení o diagnostických zdravotnických prostředcích in vitro (IVDR), které nabude účinnosti na konci tohoto měsíce, zamotala hlavu všem výrobcům a dodavatelům zdravotnických prostředků. V tuto chvíli stále ještě nemáme v Česku oznámený subjekt (dříve notifikovanou osobu), která by mohla provádět povinnou certifikaci dle MDR. Dobrou zprávou je, že by se to snad mělo změnit během druhé poloviny letošního roku, kdy by oprávnění měl dostat ITC Zlín, a následně by mohl přibýt také Český metrologický institut (ČMI). Zároveň se ale řada subjektů od výrobců po nemocnice bude muset popasovat s novými, náročnými pravidly danými nařízením. K tomu jim od července může pomoci komentář k MDR z pera autorů společnosti Porta Medica, který spoluvydává Česká agentura pro standardizaci. Přestože byla v uplynulých letech příprava na nařízení hlavním problémem výrobců, dnes ji předčil strmý růst vstupních nákladů a inflace. To by proto měla začít řešit platforma vzniklá na ministerstvu zdravotnictví.
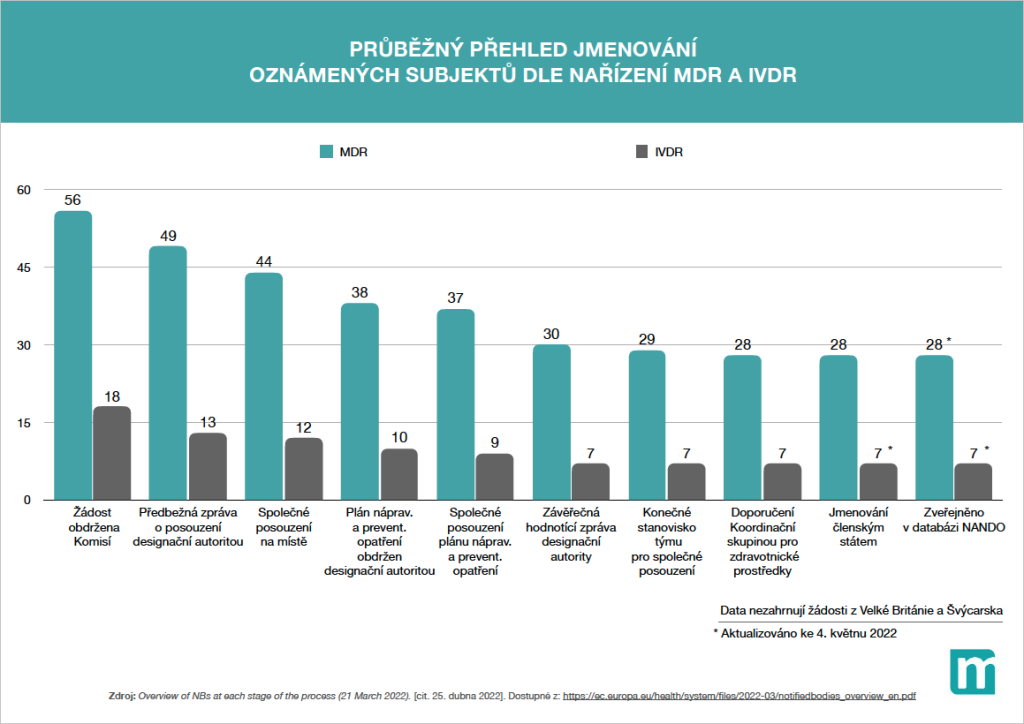
I když se na první pohled může zdát, že v Česku se poslední dobou nic moc nemění a stále nemáme vlastní oznámený subjekt, který by vydával certifikáty shody podle pravidel MDR, opak je pravdou. Dva uchazeči, soukromý ITC Zlín a „státní“ Český metrologický institut, se propracovávají složitým a náročným schvalovacím procesem, takže bychom v závěru roku mohli mít oznámené subjekty hned dva.
„ITC Zlín už je v cílové rovince – nyní čekají, až jim MDCG, tedy evropská koordinační skupina pro zdravotnické prostředky, dá konečnou zelenou. Pak už následují jen závěrečné dva ryze formální kroky, jmenování členským státem, tedy ze strany ÚNMZ, a konečné zveřejnění v evropské databázi NANDO. Je to tedy otázka konce léta, nejpozději raného podzimu. Jde ovšem o odhad, protože ne vždy jsou dodrženy všechny lhůty,“ vysvětluje právní expert ze vzdělávací a poradenské společnosti Porta Medica Jakub Král.
Druhý žadatel, Český metrologický institut, na startovní čáru nastoupil později. Ukázalo se totiž, že původní „státní“ kandidát, Elektrotechnický zkušební ústav, měl plné ruce práce i se splněním požadavků na notifikovanou osobu podle staré evropské úpravy, směrnice o zdravotnických prostředcích (MDD), která byla o poznání mírnější. Proto bylo v roce 2020 rozhodnuto, že ho v žádosti o status oznámeného subjektu dle MDR vystřídá ČMI (psali jsme také zde). Ten se s problematikou dokázal popasovat nad očekávání dobře, částečně dohnal roční skluz a dnes žádá o širší portfolio kódů než ITC Zlín (psali jsme zde).
„ČMI se nyní nachází v situaci, že má kompletně zpracovaný plán nápravných opatření, tedy reakci na to, co jim bylo vytknuto v rámci společného auditu. Plán dostane během následujícího týdne k odsouhlasení ÚNMZ, národní designační autorita, a následuje fáze zapracování všech opatření. To by se mělo odehrát do konce května. Pak se opět přejde do režimu společného posouzení, kdy se hodnocení adekvátnosti a efektivity všech přijatých opatření přesune z české úrovně na evropskou. Mělo by dojít k akceptaci širokým týmem zástupců včetně Evropské komise a designačních autorit z jiných zemí. Když ČMI získá oprávnění v posledním kvartále tohoto roku, bude to dobré,“ shrnuje Král.
Frontu na certifikace dle MDR nikdo nestojí
I když ale ani rok od startu účinnosti MDR nemáme český oznámený subjekt, zatím to v praxi neznamenalo velký problém.
„Situace není taková, že bychom tu měli frontu výrobců, kteří mají dokumentaci po novu připravenou v mašličkách, klepají na dveře potenciálního oznámeného subjektu a ptají se na to, kdy bude mít oprávnění, aby mohl certifikovat. Termín, kdy naše dva oznámené subjekty oprávnění dostanou, sice všechny velmi zajímá, ale na druhou stranu je současný stav takový, že tu prakticky nejsou výrobci, kteří by byli schopni certifikovat po novu dříve než v roce 2023,“ popisuje Jakub Král.
Mohlo by vás zajímat
K tomu, aby se výrobci i další zainteresované strany zvládli poprat s přísnými pravidly a požadavky, které musí podle MDR plnit, ale nyní budu mít k ruce velmi užitečný nástroj – totiž komplexní komentář k MDR, který podrobně rozebírá a radí, jak se popasovat s každým článkem nařízení. Komentář čítající 800 normostran doplněný procesními mapami, vývojovými diagramy, tabulkami a další infografikou je už nyní v předprodeji a zájemci ho mohou mít v červenci na stole (více zde).
„Na komentáři systematicky pracujeme od chvíle, kdy bylo MDR vydáno – sžíváme se s ním od roku 2017. Určité turbo v procesu ale způsobily aktivity evropské MDCG skupiny, jejímiž členy jsou zástupci lékových ústavů a ministerstev zdravotnictví z jednotlivých zemí, a která vytváří interpretační dokumenty pomáhající ve sjednocování výkladů. My jsme vycházeli jak z těchto dokumentů, tak z naší vlastní praxe, kdy s předpisem pracujeme na denní bázi. Nejintenzívnější tvorba probíhala během posledního tři čtvrtě roku,“ vysvětluje Jakub Král.
Cílovou skupinou jsou na prvním místě hospodářské subjekty – výrobci, dovozci a distributoři, ale komentář se bude hodit také oznámeným subjektům, lékárnám, výdejnám zdravotnických prostředků a nemocnicím. Nemocnice využijí například části týkající se karet implantátů nebo in-house zdravotnických prostředků, které si vyrábějí pro vlastní potřebu a kde dochází k velmi výrazným změnám.
Asi nejvíce se ale nemocnic, lékáren a výdejen zdravotnických prostředků dotkne problematika UDI, tedy jedinečných identifikátorů zdravotnických prostředků, což jsou unikátní číselné nebo alfanumerické kódy umožňující jednoznačnou identifikaci konkrétních prostředků na trhu, usnadňující vysledovatelnost šarží a určení původu v případě problémů. Obdobu už známe u léků v souvislosti s protipadělkovou směrnicí. Tato novinka je přitom pro nemocnice i pro výdejce velký strašák, protože mají povinnost provádět systematickou evidenci a příslušné údaje archivovat. Stejně jako u protipadělkové směrnice tak bude třeba přenastavit procesy od příjmu zdravotnických prostředků do skladu až po komunikaci a propojenost s vnitřním informačním systémem ve chvíli, kdy se objeví nějaký problém.
Česká legislativa k IVD bude snad ve třetím čtvrtletí
Na komentář k MDR by měl navázat také komentář k IVDR, což je nařízení, jehož účinnost odstartuje teď 26. května. Komentář by mohl být hotový na konci tohoto roku, ovšem těm, kdo pracují se diagnostickými zdravotnickými prostředky in vitro, může pomoci už komentář k MDR – shoda ustanovení se totiž pohybuje kolem 80 procent.
Když je řeč o IVDR, v lednu jsme informovali o tom, že jsme v Česku zaspali s navazujícími změnami v naší legislativě. Úprava, která se zasekla na legislativní radě vlády, nakonec doputovala na vládu a nyní má za sebou první čtení ve sněmovně s tím, že došlo ke zkrácení standardní 60denní lhůty na projednání ve výborech na 30 dní.
„Zpoždění je nedohnatelné, protože legislativní proces se dokončit tak, aby účinnost nového zákona o zdravotnických prostředcích a IVD byla stejná jako termín povinné použitelnosti IVDR – za tři týdny to určitě ve Sbírce zákonů nebude. Osobně očekávám, že účinnost předpisu by měla nastat někdy ve třetím kvartálu letošního roku. Vznikne tedy časový prostor, kdy už budou muset výrobci, distributoři a další regulované subjekty postupovat podle IVDR, což je přímo aplikovatelné nařízení a na českou legislativu nijak nečeká. Bude tam ale chybět nadstavba a český adaptační předpis, což například nebude dávat patřičné kompetence SÚKL. To by si hospodářské subjekty mohly vyložit jako určitou dobu hájení, kdy je lékový ústav několik měsíců nebude moci kontrolovat a sankcionovat. Řadu z nich to ale negativně doběhne, protože SÚKL nebude mít ani kompetenci vydat např. certifikát volného prodeje, což je zase věc, kterou potřebují pro export výrobků do třetích zemí,“ objasňuje Jakub Král.
Růst nákladů o desítky procent
I když měli výrobci z MDR v uplynulých letech velké obavy kvůli nárůstu nákladů, které si certifikace podle nových pravidel vyžádá, nyní mají větší problémy.
„Některé z nich velmi zasáhla covidová vlna, což se týkalo zejména výrobců implantátů, protože se do určité míry zastavila odložitelná operativa. A teď je pro většinu výrobců zásadní problém krize způsobená válkou na Ukrajině, pádivá inflace a prudký nárůst vstupních nákladů na výrobu. Upozornění z minulých let, že pro ně bude certifikace dle MDR představovat zásadní finanční problém, tak asi nyní přehodnocují. Momentálně je pro ně daleko větším problémem nákladová udržitelnost a cenová politika ve vztahu k výrobkům nezávisle na certifikaci. To dopadá na všechny výrobky, nejen na ty s novou certifikací,“ upozorňuje Král.
Proto také nyní na ministerstvu zdravotnictví vznikla platforma, kde se má diskutovat problematika cenové regulace a případných změn úhrad z veřejného zdravotního pojištění, protože s nárůstem nákladů o desítky procent jsou původní ceny a úhrady neudržitelné. Úvodní jednání proběhlo v dubnu, kdy pozvaní prezentovali, co je momentálně v oblasti regulace zdravotnických prostředků trápí. Zatím ovšem nejsou na stole žádné výstupy, jak problém řešit.
„To nás čeká v nejbližším pololetí. Do značné míry se to rozdělilo na sféru ambulantní a nemocniční. Teď v pátek má proběhnout první jednání převážně nad problematikou cenové regulace zdravotnických prostředků na poukaz, kdy se bude s ministerstvem diskutovat, zda dojde k cenové deregulaci nebo bude alespoň navýšen limit, o který mohou dodavatelé výrobky zdražit. Přidružená agenda bude, jak na to zareaguje úhrada z veřejného zdravotního pojištění. To je největší komplikace, protože zatímco cenový předpis se dá změnit takříkajíc ze dne na den, změna úhrad si vyžádá novelizaci zákona – což je na rok a více,“ uzavírá Jakub Král.

Michaela Koubová